Как составить схему образования химической связи, Урок 3. Схема образования молекул

Такая связь называется одинарной. Однако в действительности полного перехода электрона не происходит никогда. Образование такой системы может идти несколькими способами и приводит к образованию соединений с различными видами химической связи. Вопросы для самоконтроля.
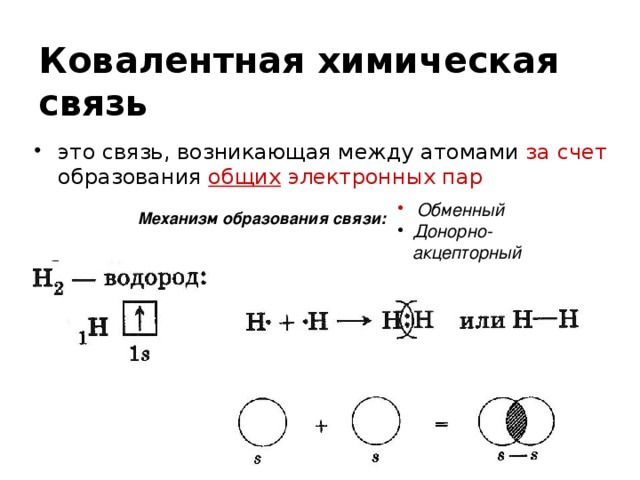
Схемы образования химических элементов бывают атомные или ковалентные полярные и неполярные , ионные, металлические, водородные:. Химический элемент — вид атомов с одинаковым положительным зарядом ядра. Химические вещества образуются из элементов, которые вступают в химические связи. Эти связи могут быть ковалентными, водородными, ионными, металлическими.
Схемы образования химических элементов. Средняя оценка: 4.
Что мы узнали? Начать тест. Доска почёта.
Если атомы неметаллов обладают одинаковой электроотрицательностью ЭО , то возникает ковалентная неполярная связь. Общая электронная пара при образовании ковалентной неполярной связи в равной мере принадлежит обоим соединяющимся атомам. Рассмотрим, каким образом образуются устойчивые электронные оболочки атомов водорода в молекуле водорода.
При составлении схемы образования ковалентной связи в молекулах можно использовать следующий алгоритм:. До завершения электронного уровня атому фтора не хватает одного электрона.
Каждый атом фтора при образовании связи предоставляет в общее пользование по одному неспаренному электрону. Это приводит к образованию общей электронной пары, в равной мере принадлежащей обоим атомам. В результате атомы фтора приобретают устойчивую восьмиэлектронную конфигурацию инертного газа неона:.
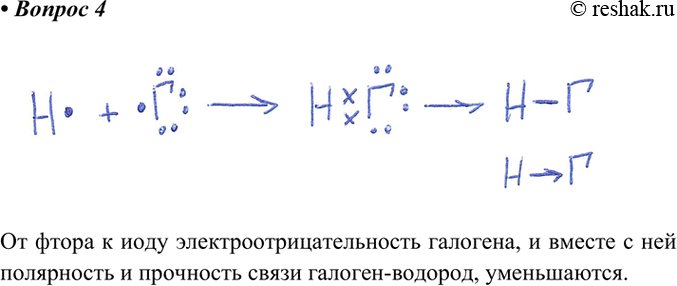
Ковалентная связь может возникнуть не только между атомами одинаковых, но и разных элементов. При этом общая электронная пара смещается к атому с большей электроотрицательностью. Как правило, ковалентная полярная связь возникает между атомами неметаллов. В молекулах фтора и хлороводорода между атомами образуется одна общая электронная пара. Такая связь называется одинарной.
Существуют также двойные и тройные ковалентные связи. Свойства ковалентной связи. Для характеристики ковалентной связи используют следующие параметры:. Перечислим основные свойства ковалентной связи. Полярность связи характеризует неравномерность распределения между атомами электронной плотности, образованной общими электронными парами. Чем больше разность электроотрицательностей атомов, тем в большей степени происходит смещение общей электронной пары, тем выше полярность связи.
Часто в молекулах с полярными ковалентными связями центры положительного и отрицательного зарядов разделены и находятся в разных точках. Молекула с разделёнными центрами положительного и отрицательного заряда называется « диполь » « диполь » означает «двуполюсный». Молекулы галогеноводородов, воды представляют собой диполи. Атом, к которому смещена общая электронная пара, приобретает частично отрицательный заряд. Однако не все молекулы с полярными связями являются диполями.
Неполярная молекула сверху и полярная молекула снизу — диполь. Насыщаемость связи характеризует возможность образования атомом ограниченного числа ковалентных связей из-за ограниченного числа неспаренных электронов. Число неспаренных электронов в атоме может быть увеличено за счёт распаривания электронов при переходе атома в возбуждённое состояние.
Основное и возбуждённое состояние.
Наличие четырёх неспаренных электронов обусловливает валентность углерода, равную четырём. Длина связи — расстояние между ядрами связанных атомов, соответствующее наименьшей энергии молекулы.
Энергия связи — энергия, которую необходимо затратить, чтобы разрушить связь.

Такое же количество энергии выделяется при образовании химической связи. Чем меньше длина связи, тем больше энергии выделяется при её образовании и, следовательно, тем она прочнее. Эту закономерность можно показать на примере галогеноводородов см.
Кратность связи — это число общих электронных пар, возникших между атомами. Чем выше кратность связи, тем больше её энергия и тем меньше длина, т. Самой короткой и самой прочной является тройная связь.
Однако в этом случае речь идёт о полном разрушении разрыве связи. Направленность связи обусловлена тем, что ковалентная связь образуется при перекрывании электронных орбиталей, которые направлены друг к другу под определённым углом.
Составьте в тетради таблицу. Рудзитис, Фельдман 8 класс химия Спишите отрывки из басен И. Крылова, верно употребляя не. ГДЗ, Упр. Габриелян О. Школа 8 класс ГДЗ Химия. Запишите схему образования химической связи в молекулах. Глава 1.
Вопрос 3. Можно ввести cимволов. Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения. Опыт 3. Это правда, что будут сокращать иностранные языки в школах? Школа Новости Иностранные языки.